L’histoire de l’atome (chap S2 - 3ème Sc. Phys)


Dès l’antiquité, les premiers "scientifiques" grecs croyaient que la matière était constituée de quatre éléments : la terre, l’eau, le feu et l’air. Cette croyance trouve une explication dans l’observation de la combustion d’un morceau de bois. Pendant la combustion, il y a production de fumée (air), de vapeur d’eau (eau) et de cendre (terre). Cette théorie quoique simple était le résultat d’observations de philosophes tel que Thalès et Empédocle.

La théorie atomique la plus originale de l’époque fût proposée au Ve siècle avant notre ère par Démocrite. Ce savant philosophe proposa que la matière était constituée de particules infiniment petites et indivisibles. Toutes substances étaient faites de ces particules. Entre ces particules existait un espace vide.
Démocrite n’étant pas un philosophe très populaire en son temps, sa théorie ne trouva aucun appuie et elle fût donc rejetée au profit d’une théorie de la continuité de la matière proposée par Aristote .

Aristote s’appuyait sur le concept des quatre éléments de base de Thalès et affirmait que les atomos ne pouvaient exister puisque invisibles à ses yeux. La conception aristotélicienne de la matière reçue l’appuie des religieux de l’époque et traversa les siècles qui suivirent jusqu’au 18e siècle.
Au Moyen Âge l’alchimie, axée principalement sur la découverte d’une substance (la pierre philosophale) qui transformerait les métaux les plus communs en or ou en argent, et sur la découverte de moyens permettant de prolonger la vie des hommes est, de bien des façons, le précurseur de la science moderne, en particulier de la chimie. Même si ses buts et ses techniques étaient douteux et souvent illusoires, le concept fondamental de l’alchimie dérivait de la doctrine aristotélicienne selon laquelle toute chose tend à atteindre la perfection. Les alchimistes pensaient que les métaux étaient moins « parfaits » que l’or. Il était donc raisonnable de supposer que la nature avait constitué l’or à part des autres métaux enfouis profondément sous terre, et qu’avec suffisamment de dextérité et d’assiduité, un artisan pourrait reproduire cette synthèse dans son atelier. Les efforts pour atteindre ce but étaient tout d’abord empiriques et pratiques, mais au IVe siècle apr. J.-C., l’astrologie, la magie et les rites devinrent prédominants. Les alchimistes arabes travaillaient avec l’or et le mercure, l’arsenic et le soufre, les sels et les acides. Ils se familiarisèrent avec une large gamme de ce que l’on appelle maintenant les réactifs chimiques. Ils croyaient que les métaux étaient des corps composés, constitués de mercure et de soufre en différentes proportions. Leurs principes scientifiques étaient la potentialité de la transmutation et leurs méthodes étaient pour la plupart des tâtonnements à l’aveuglette. Cependant, ils trouvèrent de cette façon de nombreuses substances nouvelles et inventèrent de nombreux procédés utiles. En provenance de l’Arabie, l’alchimie se propagea, dans l’ensemble, à travers l’Espagne et l’Europe. Les premiers travaux authentiques de l’alchimie européenne existant encore sont ceux du moine anglais Roger Bacon et du philosophe allemand Albert le Grand. Tous deux croyaient en la possibilité de transmuter les métaux inférieurs en or. Cette idée excita l’imagination - et plus tard l’avarice - d’un grand nombre de personnes au Moyen Âge. Ces dernières croyaient que l’or était le métal parfait et que les métaux plus vils étaient plus imparfaits que l’or. Cependant, ils cherchèrent à fabriquer ou à découvrir une substance, appelée la pierre philosophale, beaucoup plus parfaite que l’or, et qui pouvait être utilisée pour amener les métaux de base jusqu’à la perfection de l’or.
Des savants commencèrent à progresser dans la connaissance de la matière et a remettre en doutes les concepts aristotéliciens du monde et de la matière. L’expérimentation et la présentation devant le roi d’expériences simples devenaient à la mode.

Robert Boyle (chimiste anglais du 17e siècle) proposa que la matière était faite de quelques substances simples appelées éléments.

Antoine-Laurent Lavoisier réussit à décomposer l’oxyde de mercure et énonça la loi de la conservation de la masse. Le fameux "rien ne se perd, rien ne se crée, tout se transforme".
__degrade.png__
[rouge]Le premier modèle de l’atome[/rouge]

Dalton, John (1766-1844), chimiste et physicien britannique, qui développa la théorie atomique sur laquelle fut fondée la science physique moderne.
Observations et essais météorologiques (1793), ne suscita que peu d’intérêt. L’année suivante, il présenta un article sur le daltonisme, maladie dont Dalton souffrait lui-même, devant la société philosophique et littéraire de Manchester. Cet article fut la toute première description de ce phénomène.
La plus importante contribution de Dalton à la science fut sa théorie selon laquelle la matière est composée d’atomes indivisibles de différentes masses et qu’elle se combine en respectant des proportions massiques simples. Cette théorie, que Dalton proposa pour la première fois en 1803, est la pierre d’angle de la science physique moderne. En 1808, l’oeuvre de Dalton intitulée Un nouveau système de philosophie chimique fut publiée. Dans ce livre, il dressa la liste des masses atomiques d’un certain nombre d’éléments connus par rapport à la masse de l’hydrogène. Ses masses n’étaient pas entièrement correctes mais elles forment la base de la table périodique moderne des éléments. Dalton arriva à sa théorie atomique par une étude des propriétés physiques de l’air atmosphérique et des autres gaz.
En 1804 et 1809, Dalton fut invité à enseigner à Londres. Il devint membre de la Royal Society en 1822. Il fut récompensé par la médaille d’or de la société en 1826. En 1830, Dalton devint l’un des huit associés étrangers de l’Académie française des sciences. Il mourut à Manchester le 27 juillet 1844. Dalton étudia une maladie transmise génétiquement le daltonisme.

Voici les principes importants de la théorie de Dalton :
- La matière est composée de particules invisibles, indivisibles, massiques appelées atomes
- Les atomes d’un élément donné sont identiques
- Les atomes d’éléments différents sont uniques
- Les atomes d’éléments simples se combinent dans des proportions bien définies pour former des atomes composés (les composés)
__degrade.png__

Mickaël FARADAY,(1791-1867), chimiste et physicien britannique né à Newington, fit d’importants travaux dans le domaine de l’électricité et du magnétisme. En 1832, il réalise une électrolyse. Il fait passer un courant électrique dans une cuve remplie d’eau, et constate que du dihydrogène se dégage à l’électrode négative, et du dioxygène à l’électrode positive. En mesurant la quantité de gaz produits, il se rend compte qu’elle dépend directement de la quantité d’électricité qui a circulé dans la cuve ; le courant électrique coupe apparemment l’eau en ses 2 éléments chimiques de base (cela s’appelle une électrolyse). Faraday ne voit qu’une explication au phénomène : L’électricité doit être, d’une manière ou d’une autre, la force qui lie les atomes entre eux.
__degrade.png__

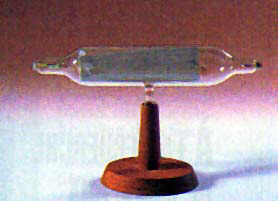
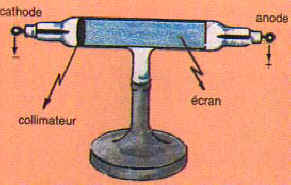
Sir William Crookes,(1832-1919), chimiste et physicien britannique né à Londres inventa le tube électronique à cathode froide appelé aujourd’hui tube de Crookes.
Ses recherches les plus importantes portèrent sur la conductivité électrique des gaz. Il mit au point le tube de Crookes et fut le premier à produire des rayons cathodiques dans celui-ci. Il inventa également le radiomètre et le spinthariscope, un détecteur de particules. Il mena des recherches dans de nombreux domaines. Il découvrit le thallium.
|
|
__degrade.png__
[rouge]Le deuxième modèle atomique[/rouge]
Sir Joseph John Thomson, (1856-1940), physicien de nationalité anglaise, lauréat du prix Nobel. Thomson reçut en 1906 le prix Nobel de physique pour son travail sur la conduction de l’électricité par les gaz.
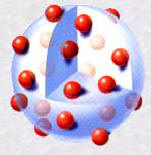
Grâce à la découverte de Crookes, Thomson est à l’origine de la découverte de l’électron par ses expérimentations sur les flux de particules (électrons) créés par des rayons cathodiques.Théoricien et expérimentateur, Thomson avança en 1898 la théorie du « pain aux raisins » sur la structure atomique, dans laquelle les électrons sont considérés comme des « raisins » négatifs enfoncés dans un « pain » de matière positive. On appelle souvent le modèle de Thomson, modèle du pain aux raisins (ou encore le pudding).

Becquerel, Henri (1852-1908), physicien français lauréat du prix Nobel, qui découvrit la radioactivité de l’uranium.
En 1896, il découvrit accidentellement le phénomène de la radioactivité au cours de ses recherches sur la fluorescence. Après avoir placé des sels d’uranium sur une plaque photographique dans un lieu sombre, Becquerel s’aperçut que la plaque avait noirci. Ce fait prouvait que l’uranium dégage de l’énergie, phénomène connu par la suite sous le nom de radioactivité. En 1903, (1852-1908), physicien français lauréat du prix Nobel, qui découvrit la radioactivité de l’uranium.
En 1896, il découvrit accidentellement le phénomène de la radioactivité au cours de ses recherches sur la fluorescence. Après avoir placé des sels d’uranium dans un lieu sombre, Becquerel s’aperçut que la plaque avait noirci. Ce fait prouvait que l’uranium dégage de l’énergie, phénomène connu par la suite sous le nom de radioactivité. En 1903, Becquerel partagea le prix Nobel de physique avec les physiciens français Pierre et Marie Curie pour leur travail sur la radioactivité.

Curie, Marie (1867-1934), physicienne française d’origine polonaise, à l’origine de la découverte des éléments chimiques radium et polonium, prix Nobel en 1903. Elle obtint également le prix Nobel de chimie en 1911. L’étude des éléments radioactifs par le couple Curie contribua à la compréhension des processus atomiques , fondement de la physique nucléaire moderne.
__degrade.png__
[rouge]Le troisième modèle atomique[/rouge]

Lord, Ernest Rutherford, (1871-1937), physicien britannique, il fut lauréat du prix Nobel pour ses travaux en physique nucléaire et pour sa théorie relative à la structure de l’atome.
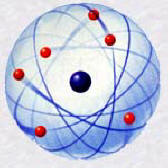
Rutherford fut l’un des premiers et des plus importants chercheurs dans le domaine de la physique nucléaire. Peu de temps après la découverte de la radioactivité, en 1896, par le physicien français Henri Becquerel, Rutherford identifia les trois composants principaux du rayonnement, qu’il baptisa respectivement rayonnements alpha, bêta et gamma. Il montra également que les particules alpha étaient en fait des noyaux d’hélium. Son étude du rayonnement le conduisit à élaborer une théorie de la structure atomique. Il fut ainsi le premier à décrire l’atome comme un noyau dense autour duquel gravitent des électrons.
__degrade.png__
[rouge]Le dernier modèle atomique[/rouge]

Bohr, Niels Henrik David (1885-1962), physicien danois, prix Nobel en 1922, pour sa contribution à la physique nucléaire et à la compréhension de la structure atomique.
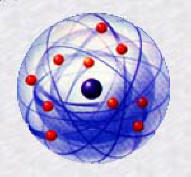
La théorie de Bohr sur la structure atomique, pour laquelle il reçut le prix Nobel de physique, fut publiée entre 1913 et 1915. Son travail s’inspira du modèle nucléaire de l’atome de Rutherford, dans lequel l’atome est considéré comme un noyau compact entouré d’un essaim d’électrons. Le modèle propose que les électrons qui gravitent autour du noyau sont situés sur des niveaux d’énergie. Bohr a identifié sept niveaux d’énergie autour du noyau. De plus chaque niveau d’énergie ne peut contenir qu’un nombre maximum d’électron. Ce modèle contribua énormément aux développements ultérieurs de la physique atomique théorique. C’est ce modèle qui est encore en vigueur.
__degrade.png__
[rouge]Vers le modèle quantique[/rouge]
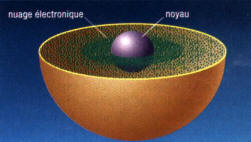
Le modèle de Bohr est le dernier modèle obéissant à la physique classique, c’est-à-dire la physique qui explique les mouvements et les phénomènes existant à notre échelle humaine. Ces modèles d’atomes sont donc faciles à comprendre et à se représenter.
Quel plaisir intellectuel (et quelle paresse !) que de se représenter les atomes sous forme de petites boules tournant les unes autour des autres...
Ce modèle est d’ailleurs toujours celui que le grand public affectionne !
Eh bien ce modèle est faux car à l’échelle atomique, de nouvelles lois s’appliquent ! Ces lois appartiennent à une étrange physique très éloignée de nos concepts courant : la physique quantique.
Adapté de l’encyclopédie Encarta 97 de Microsoft

